В 2011 г. Lampe JW. и Becker LB. была предложена обобщающая схема механизмов действия ТГ [80], представленная на рис. 17. Она позволяет составить общую картину влияния процессов понижения температуры мозга на патогенетические механизмы по- вреждения нейронов в условиях тотальной ишемии/гипоксии и реперфузии.
Большой объём выполненных экспериментальных и клинических исследований позволяет вполне обоснованно рассматривать ТГ, как метод нейропротекции, оказывающий положительное влияние на большинство ключевых механизмов вторичных повреждений нейронов.
Так, депрессия метаболизма в клетках при понижении их температуры традиционно рассматривается как важная составляющая нейропротективного действия гипотермии [81]. Снижение потребности в кислороде, субстрате и АТФ способствует уменьшению реакций нейронов на ишемию, удлиняет период их жизни в условиях гипоперфузии. Уменьшается выброс ВАК, активность клеточного дыхания и продукция свободных радикалов, трансмембранная проницаемость, провоцируемые ишемическим каскадом [82].
Ограничение местного воспаления при ишемии и нейротравме в условиях ТГ [83] сопровождается снижением провоспалительных факторов, миграции лейкоцитов и инфильтрации ими ткани мозга [84], снижается отек и уменьшается ВЧД [85]. В условиях гипотермии уменьшается объем повреждения нервной ткани и предупреждается гибель нейронов, как по некробиотическому типу, так и путем апоптоза [86-88]. Существенно, что влияние ТГ на развитие патогенетических реакций показано как в острой фазе ишемии, так и в период реперфузии.
В большом экспериментальном исследовании эффектов ТГ при СЛР показано, что мягкая гипотермия (mild hypothermia, 32-34°С) повышает сохранность нейронов подкорковых структур и коры после 10 минутной остановки сердца у кошек, улучшает восстановление основных показателей гомеостаза (гликемия, КОС) и повышает выживаемость на 18-20% по сравнению с СЛР у животных с нормотермией. В тоже время в эксперименте показано, что после СЛР и реперфузии при моделировании инфаркта миокарда и воспроизведения умеренной общей гипотермии (moderate hypothermia, 29-32°С) ТГ несет высокий риск развития фибрилляции, но улучшает неврологический статус у собак [89].
В экспериментальных работах, подтверждающих существенное ограничение морфологических последствий вторичных повреждений при острой ишемии мозга и общем охлаждении, подчеркивается влияние ТГ на патогенетические каскады, инициируемые реперфузией и делается вывод о возможности расширения терапевтического окна для фармакотерапии, в том числе тромболизиса, при раннем охлаждении [90].
Европейская научная группа (Hypothermia After Cardiac Arrest – HACA) в 1993 г. опубликовала данные мультицентрового рандомизированного исследования, включившего 275 пациентов старше 18 лет, (9 центров в пяти странах) со стандартной мягкой ТГ (+32-34°С) после остановки сердца, фибрилляции и восстановления спонтанного кровообращения, начатой не более чем через 60 минут. ОТГ воспроизводили на протяжении 24 часов с последующим спонтанным согреванием. Позитивные неврологические исходы отмечены у 55% пациентов после ТГ и у 39% пациентов без ТГ с мета анализом спустя 6 месяцев [91]. Эти результаты хорошо совпадают с данными Nagao K. e.a. (2002), в которых отмечен хороший неврологический статус у пациентов после СЛР и стандартной ТГ в 57% случаев [92].
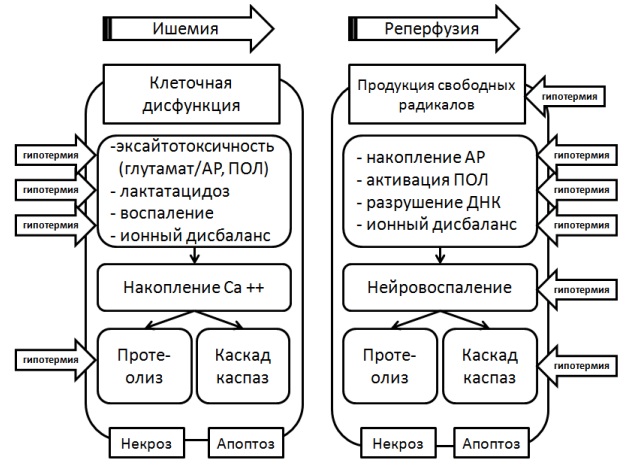
Рис. 17: Схема механизмов терапевтического действия ТГ (по Lampe JW. и Becker LB., 2011)
Австралийская группа изучения ТГ приводит данные о хорошей неврологической реабилитации у 49% больных, выживших после СЛР с применением ТГ и у 26% больных, которым ТГ не применялась [93]. В условиях внегоспитальной остановки сердца риск гибели пациентов снижается на 20% при условии, что охлаждение начинают в первый час после восстановления сердечной деятельности [94].
Не смотря на позитивный неврологический прогноз у пациентов после глобальной ишемии, результаты ТГ оказались существенно зависимы от типа согревания [95]. Так, показано, что высокий темп подъема температуры тела после мягкой ОТГ более 1°С/час (от +32 до +37°С) и особенно после умеренной ОТГ способен провоцировать грубые нарушения сердечного ритма.
Большинство клинических результатов позитивного нейропротективного применения ТГ получено у больных после СЛР и при тяжелой нейротравме [96], прежде всего потому, что методика общего охлаждения применялась в условиях медицинского сопровождения, соответствующего состоянию больных и условиям применения ОТГ (атараксия, интубация, ИВЛ, миорелаксация).
Как показывает клиническая практика, состояние многих пациентов, перенесших ишемический инсульт, не требует интубации трахеи и вентиляции. К тому же, доказанные нейропротективные эффекты гипотермии предполагают наиболее успешное применение методики у больных средней тяжести и находящихся в сознании, а показаний к применению охлаждения будет существенно больше, если удастся избежать интубации и дополнительной седации пациентов [97].
Данная предпосылка явилась основанием разработки методики очень мягкой гипотермии со снижением температуры теплового центра организма в пределах +35-36°С, что не требует фармакологического подавления мышечной дрожи, применения ИВЛ и общей анестезии [98]. Однако, как известно, эффективность нейропротекции оказывается тем выше, чем ниже температура головного мозга, а не тела.
В частности, при моделировании ишемического инсульта у крыс показано, что нейропротективные свойства ТГ начинают проявляться при температуре тела ниже +35°С, приводя к уменьшению объема инфаркта мозга на 44% по сравнению с животными с более высокой температурой, причем достаточно охлаждать 3-4 часа, чтобы значительно сократить размер инфаркта мозга [99].
Оценка клинических результатов применения ТГ при ишемическом инсульте часто оказывается затруднительной в связи с разнообразием hypothermia in the majority of moderate or severely affected stroke patients would be more применяемых методик, где существенно различались начало охлаждения, воспроизведение поверхностного или трансвенозного общего охлаждения разной глубины и длительности. Так, в объединенном исследовании при проведении архивного анализа применения ОТГ у 423 пациентов, который не учитывал особенности деталей проведенной процедуры охлаждения (начало от дебюта, глубина охлаждения, темп согревания, тяжесть течения и т.д.) не были выявлены существенные различия в контрольной и основной группах по смертности или успешности терапии через 1 и 3 месяца после инсульта [100]. Критическое восприятие применения ОТГ при инсультах продолжает влиять на частоту её применения и это учитывалось, частности, при принятии решения о проведении многоцентрового исследования EuroHyp-1.
Тем не менее показан положительный эффект применения ТГ при ишемическом инсульте и перспективность применения методики общего охлаждения в сочетании с тромболитической терапией [101]. Отмечено также, что высокий нейропротективный потенциал ТГ позволяет достичь хороших клинических результатов, но в многоцентровых исследованиях оказывается статистически малозначимым в связи с неоднородностью выборки по тяжести поражения мозга и разнообразием методик индукции гипотермии, а перспективы применения ТГ при инсульте связаны с разработкой стандартных методик и рационального сочетания с фармакотерапией.
Значение методического исполнения ТГ при инсульте подчеркивается во многих работах. В частности, в работе Krieger (2001) [102] показано, что быстрое согревание после гипотермии может привести к развитию реактивного отека мозга. В экспериментальной работе было обнаружено, что задержка в применении ТГ более 3-х часов от момента моделирования ишемии мозга существенно снижает эффективность сеанса гипотермии [103], в это же время в клинических исследованиях показали, что охлаждение в течение 24 часов позволяет достичь отчетливых нейропротективных эффектов, даже если лечение было отложено на 6 часов после дебюта ишемического инсульта [104]. Кроме того, оказывается очень важным обеспечить адекватную состоянию пациента длительность охлаждения, поскольку короткий период снижения температуры может не обеспечить достаточный уровень защиты нейронов, а развитие нежелательных сосудистых реакций при преждевременном согревании способно вызвать обратный результат. Здесь же отмечено, что ТГ снижает риск развития ФНВК после СЛР [105].
Накоплены клинические данные об успешном сочетании ТГ с принятыми протоколами фармакологической терапии при ишемическом инсульте, включая реперфузионную терапию, препараты магния и антиоксиданты [106].
Эффекты ТГ начинают себя проявлять только при достаточном уровне снижения температуры мозга и продолжаются в период эффективной гипотермии, проявляя выраженное воздействие на течение патологического процесса при условии включения охлаждения в комплексную терапию с учетом терапевтического окна, то есть желательно, в первые 24 часа от начала заболевания.
К настоящему времени сформировались основные подходы применения ТГ при СЛР, нейротравме и ОНМК. У крайне тяжелых пациентов применяют ОТГ в соответствии с Методическими рекомендация Европейского Совета по реанимации (2010, 2015). В целях осуществления температурного менеджмента и предупреждения нежелательных последствий центральной лихорадки, а также для потенцирования нейропротекторной терапии, предлагают использование очень мягкой гипотермии. Кроме того, следует учитывать позитивный опыт применения краниоцеребрального охлаждения, позволяющего индуцировать не только КЦГ, но и мягкую ОТГ.
Вне зависимости от выбора методики требуется постоянно и тщательно контролировать глубину и фокальность развития гипотермии, что подразумевает применение в первую очередь аппаратной ТГ и адекватного термомониторинга. Последнее чрезвычайно важно, так как регресс и прогрессирование неврологического дефицита прямо связано со значениями температуры головного мозга – повышение температуры коры мозга на 0,2°С увеличивает дефицит на ~ 1 балл [107].
