Непосредственно с момента развития ОНМК или нейротравмы, чрезвычайно быстро формирующих первичный очаг повреждения, резко нарастает энергетический дефицит нейронов [63], сопровождающийся их возбуждением и массивным выбросом возбуждающих аминокислот (ВАК – глутамат и аспартат) [64]. Гипоксия и недостаток субстрата быстро приводят к нарушениям трансмембранного потенциала, синаптической передачи, аксонального транспорта и потенциала действия [65]. Возбуждение усугубляет энергетический дефицит, усиливающий развитие эффектов “эксайтотоксичности”, сопровождающихся резким выбросом ВАК, [66] нарушениями кальциевого гомеостаза нейронов [67], развитием лактатацидоза [68], накоплением свободно-радикальных соединений и активацией ПОЛ [69].
Оксидантный стресс и локальное воспаление [70] начинают проявляться в первые 2-3 часа ОНМК, достигая максимума через 12-36 часов, обеспечивая основу развития отдаленных последствий ишемии, которые в основном формируются ко 2-3-им суткам, чему также способствует активация апоптотической гибели нейронов [71]. На рис. 16 представлена последовательность и длительность развития основных механизмов патогенеза повреждения нейронов [72].
Области мозга в зоне ишемии необратимо повреждаются в течение 6–8 мин и формируют «ядерную» зону инфаркта, вокруг которой образуется «ишемическая полутень» или пенумбра. В области пенумбры в течение нескольких часов сохраняется метаболическая активность и присутствуют лишь функциональные изменения нейронов, сохранность которых в большой мере определяется уровнем перфузии этой области мозга. Некоторые отделы мозга оказываются особенно чувствительны к ишемии (гиппокамп, неокортекс мозжечок, полосатое тело, таламус) [73].
Восстановление адекватной перфузии и эффективная нейропротекция, направленные на сохранение нейронов «полутени», являются главной задачей терапии инсульта начиная с первых часов заболевания.
Время жизни нейронов в области пенумбры определяет длительность «терапевтического окна» – периода, в течение которого лечебные мероприятия оказываются наиболее эффективными.
Тромболитическая терапия с применением рекомбинантного тканевого активатора плазминогена (tPA) на сегодняшний является наиболее эффективным способом, восстановления кровотока и предотвращения необратимых изменений в ткани мозга [74]. Однако узость терапевтического окна, не превышающая 4-6 часов от дебюта ОНМК, и опасность развития геморрагических осложнений не позволяют использовать тромболизис более чем в 10% случаев [75].
Существенно, что восстановление кровотока, то есть реперфузия, также провоцирует развитие каскада патологических реакций [76]. Вначале развивается постишемическая гиперперфузия, резко усиливающая оксидантный стресс на фоне истощения эндогенных антиоксидантных систем, эффекты нейротоксичности нарастают. Далее может развиться постишемическая гипоперфузия с нарушениями микроциркуляции и формированием феномена не восстановленного кровотока (ФНВК) [77], что способно существенно ухудшить результаты терапии.
Реперфузия запускает свободнорадикальное окисление, причем повреждение мембран нейронов начинается через несколько минут после восстановления кровотока, чрезвычайно активно в первые часы и может продолжаться несколько дней [78]. Реперфузионный синдром становится важнейшим фактором патогенеза после реваскуляризации, а повреждения им вызванные могут оказаться больше по объему, чем сформированный ишемией первичный очаг.
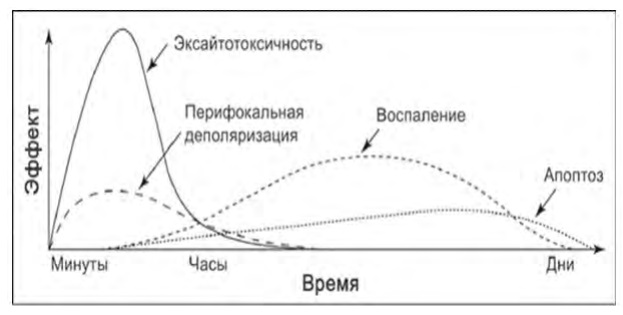
Рис. 16: Основные механизмы повреждения нейронов в области пенумбры и периоды их развития
Помимо активации свободнорадикальных процессов, истощающих собственный антиоксидантный потенциал нейронов и повреждающих мембраны органелл, реперфузия усиливает эффекты эксайтотоксичности, воспаления, а открытие митохондриальных пор усиливает оксидантный стресс и активирует апоптоз при выходе в протоплазму цитохрома С.
Негативные эффекты реперфузии оказываются столь значительными, что возникает мысль о том, что терапевтический потенциал реваскуляризационной терапии достиг своего потолка. В тоже время, очевидно, что альтернативы методам реваскуляризации в остром периоде ишемии нет. Из этого следует, что необходима разработка средств и методов, способных корригировать как ишемические, так и реперфузионные повреждения. Не следует уменьшать и роль местной воспалительной реакции, сопровождающейся накоплением провоспалительных цитокинов, инфильтрацией ткани мозга лейкоцитами и обеспечивающей условия развития нейрогенной лихорадки [79].
Фармакологическая нейропротекция направлена на конкретные механизмы патогенеза и требует использования широкого спектра препаратов. Используют антагонисты NMDA-рецепторов, например, препараты магния. Ограничения возбуждающей нейротрансмиссии, в определенной степени, удается добиться при помощи тормозных аминокислот (глицин, ГАМК).
Для подавления патогенетических реакций используют средства, обладающие антиоксидантными эффектами, препараты, способствующие торможению местной воспалительной реакции (антагонисты провоспалительных цитокинов и молекул клеточной адгезии) и улучшению трофического обеспечения мозга (нейротрофины), а также нейроиммуномодуляторы (нейропептиды), регуляторы рецепторных структур (ганглиозиды). Дегидратационная терапии отека мозга и коррекция лихорадочных состояний также являются важной частью нейропротективной терапии.
Таким образом, патогенетическая нейропротективная терапия ОНМК требует применения широкого круга препаратов различного типа действия.
