Результаты поиска эффективных нейропротекторных средств для применения в остром периоде ишемического инсульта продолжает вызывать разочарование специалистов. Однако достаточно широкий круг работ, выполненных в последнее время, позволяет позитивно оценить перспективы гипотермии и ишемического прекондиционирования. Особенно в плане повышения устойчивости нейронов к действию ишемии и реперфузии. Оба типа воздействия оказались объединены едиными механизмами реализации, заключающимися в обратимом подавлении клеточного метаболизма и экспрессии генов раннего реагирования.
Впервые описанный применительно к миокарду, феномен ишемического прекондиционирования был обнаружен R. Lange и C.E. Murry (1984-1986). Они показали, что содержание АТФ в миокарде после повторных коротких периодов ишемии снижается меньше, чем при однократном эпизоде. При последующей окклюзии венечной артерии АТФ был на 25% меньше по сравнению с таковым в контроле. Клинические ретроспективные исследования подтвердили благоприятное влияние стенокардии на течение острого инфаркта миокарда [108].
Применение ишемического прекондиционирования с целью предупреждения развития инфаркта миокарда у пациентов с планируемой окклюзией коронарных артерий несет в себе риск возникновения жизнеопасных аритмий. В этой связи, в качестве прекондиционирующего фактора более безопасно применять тренировку к гипоксическим состояниям. Они вызываются снижением содержания кислорода в атмосферном воздухе. На моделях гипоксического прекондиционирования было показано эффективное предотвращение ишемического повреждения сердца и головного мозга.
Было установлено, что реакции ишемически/гипоксического прекондиционирования осуществляются при участии аденозиновых рецепторов А1, а также брадикинина и эндогенных опиоидов. Наиболее вероятными претендентами на роль конечного эффектора прекондиционирования являются КАТФ-каналы и МРТ-пора. Они представляют собой белковый комплекс, расположенный на мембране митохондрий, с активностью которого связан выход в цитоплазму цитохрома С и активация апоптоза. Прекондиционирование усиливает продукцию ряда белков, определяющих толерантность клетки к ишемии.
Bcl-2 ингибирует МРТ-пору и супрессирует синтез белка Bax, который способствует открытию МРТ поры [110, 111].
Ишемическая толерантность к летальной ишемии, вырабатывающаяся после предъявленных периодов действия сутерминальных воздействий инициируется механизмами генного перепрограммирования. Его результатом является синтез белков de novo, обеспечивающих повышение устойчивости клеток к терминальным воздействиям.
Ишемическая толерантность формируется в виде «раннего окна». Она развивается через несколько минут после периодов сублетальной ишемии и длится в течение нескольких часов, и «позднего окна». Позднее окно развивается через 2-3 часа и длится несколько суток. Ишемическая толерантность, развивающаяся при гипотермии, также связана с активацией генов раннего реагирования. В результате формируется цитопротекторный фенотип клетки, поддерживаемый вновь синтезируемыми белками. Это проявляется в повышении устойчивости клетки к действию активных форм кислорода, способствует стабилизации мембран, уменьшает воспалительный ответ. В основе данных процессов видятся выработавшиеся в процессе эволюции типовые защитно-приспособительные реакции. Они позволяют выжить организмам в условиях низких температур и значительной депрессии кровообращения, как, например, у гибернирующих животных.
Падение перфузии, изменения ионного транспорта, трансмембранного потенциала, глутаматный «удар» и оксидантный стресс, как нарушения теплового баланса нейрона, влекут за собой неспецифический ответ генома. Он проявляется в активации генов раннего (немедленного) реагирования (c-fos, c-jun, krox-20, zif/268 и др.), или «третичных мессенджеров». От рецепторов и мембран сигнал о действии на клетку чрезвычайного раздражителя передается к ядру нейронов, где и начинается экспрессия генов. Это в итоге формирует активный синтез цитопротекторных белков.
В частности, в экспериментальных моделях с фокальной ишемией мозга установлено, что экспрессия гена основного стресс-белка HSP729 регистрируется в ограниченной области мозга с уровнем снижения мозгового кровотока ниже 50% от нормы и только в клетках, остающихся жизнеспособными. В ядерной зоне ишемии экспрессия гена HSP72 отмечается в клетках эндотелия сосудов, более резистентных к ишемии, в маргинальной области инфаркта и в глиальных клетках.
В ответ на острую церебральную ишемию вслед за экспрессией генов и синтезом HSP развивается следующая волна геномного ответа. Она обеспечивает синтез веществ, принимающих участие в основных механизмах отсроченной гибели клеток – провоспалительных цитокинов, молекул адгезии, ферментов (синтазы iNOS, циклооксигеназы-2), участвующих в механизмах оксидантного стресса и формирования воспаления. Известная динамика в последовательности разрушительных процессов после острой ишемии обусловлена динамикой развития геномного ответа.
Из этого следует, что кратковременная сублетальная ишемия в первую очередь запускает механизмы цитопротекци. Они в условиях продолжения действия экстремального фактора, сменяются цитодеструктивными реакциями. Такая последовательность событий позволяет прекондиционирующим воздействиям сформировать толерантность клетки к последующим уже терминальным повреждениям.
Приведем некоторые данные о их роли в защите клетки при ишемии/гипоксии/реперфузии.
Мы уже упомянули в качестве основного белка цитопротекции HSP72. Уже незначительное – на 2-3°С, снижение или повышение температуры нейронов лавинообразно увеличивает синтез НSP с различной молекулярной массой (НSP20-70 кДа). Их уровень в клетке может возрасти в 3-5 раз в течение часа [112]. Значение температурного гомеостаза нейронов оказывается настолько важным, что природа предусмотрела наличие, как минимум, еще одной системы реагирования на гипотермический сигнал, запускающий активную продукцию белков холодового шока.
НSP и CHP относятся к классу высоко консервативных белков-шаперонов. Их основные функции являются фолдинг белка, рефолдинг, ренатурация, стабилизация мембран органелл и клетки, предупреждение ионного дисбаланса, угнетение свободно-радикальных процессов и воспалительной реакции. Перечисленные эффекты действия белков-шаперонов обеспечивают ограничение развития практически всех типовых реакций вторичных повреждений нейронов. Именно с нарастанием их синтеза связывают формирование цитопротекторного фенотипа клетки. Это в итоге формирует условия, приводящие к уменьшению зоны инфаркта миокарда на 35-65%, объема повреждения мозга на 25-52% при острых нарушениях коронарного и церебрального кровообращения [114].
Фактов того, что белки-шапероны обеспечивают формирование толерантности нейронов к ишемии накоплено, достаточно много. Наиболее полно они обобщены в экспериментальной работе Rzechorzek N.M. (2015). [115] Там же представлены собственные материалы автора, позволяющие по-новому оценивать перспективы применения гипотермии мозга при различных патологических состояниях.
В частности, показано, что понижение температуры мозга в течение 3-4-х часов провоцирует транскрипцию гена раннего реагирования FOS. Его количество в нейронах троекратно нарастает при снижении церебральной температуры до 32°С и еще более значимо увеличивается при 28°С. Отмечено особенно выраженное увеличение спустя 24 часа после гипотермии. При этом, синтез цитопротекторных белков CHP RBM310 увеличивается многократно и особенно значимо при снижении температуры до 28°С спустя 24 часа после охлаждения.
Не менее интересно и то, что похожие реакции развиваются при активации гена раннего реагирования JUN. Он обеспечивает значительное нарастание синтеза шаперона CHP CIRBP11, причем также наиболее значимо через 24 часа после окончания индукции гипотермии (рис.18).
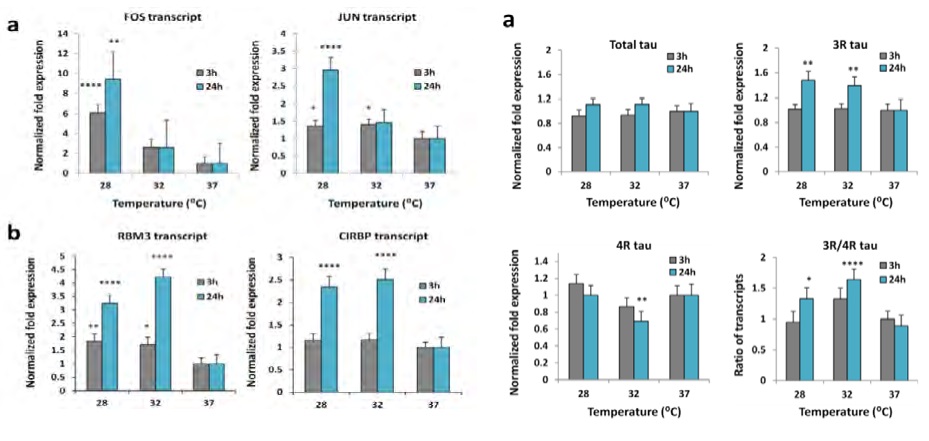
Рис.18: Гены раннего реагирования с-fos и с-jun запускают процессинг шаперонов-CSP обеспечивающих неспецифическую цитопротекцию на протяжении более суток
Эти данные свидетельствуют о следующих примечательных фактах и позволяют сделать некоторые перспективные выводы.
Во-первых, с высокой достоверностью показано, что вполне допустимое, применительно к нейронам головного мозга, понижение температуры (до 28°С) обеспечивает генетически обусловленное значительное увеличение синтеза цитопротективных белков.
Во-вторых, максимальное накопление белков цитопротекции отмечено через 24 часа после охлаждения.
В этой закономерности прослеживаются последовательности, свойственные ишемически/метаболическому прекондиционированию (позднее окно). Указанные особенности позволили Rzechorzek N.M. заключить, что «запустив программы цитопротекторной защиты можно пожинать плоды охлаждения без охлаждения пациента»! Эта мысль чрезвычайно благодатна для обсуждения эффектов КЦГ. Участие CHP CIRBP в изменении соотношения синтеза форм МАР-tau12 способствует восстановлению поврежденной микротубулярной системы нейрона, улучшению аксонального транспорта, сохранению и восстановлению цитоскелета клетки. Кроме того, CHP CIRBP участвует в рефолдинге патологических белков, в частности бета-амилоида, из чего можно предположить позитивную роль гипотермии нейронов в предупреждении развития нейродегенеративных процессов.
Температура (с-fos и с-jun) меняет синтез 3R/4R форм МАР-tau, восстанавливая цитоскелет нейрона.
